- Vue d'ensemble
- Définition
- Exemples de compléments alimentaires à base de plantes médicinales
- Plantes dans les compléments alimentaires
- Acheter de l'alcool
- Etiquetage
- Allégations nutritionnelles et de santé
- Déclaration des compléments alimentaires
- Cueillette de plantes sauvages
- Cultiver les PPAM : la question des contaminants
- Dossier qualité
- Dossier toxicologique
- Bonnes pratiques d'hygiène
- Métrologie
- Vente
- Ressources utiles
Vue d’ensemble
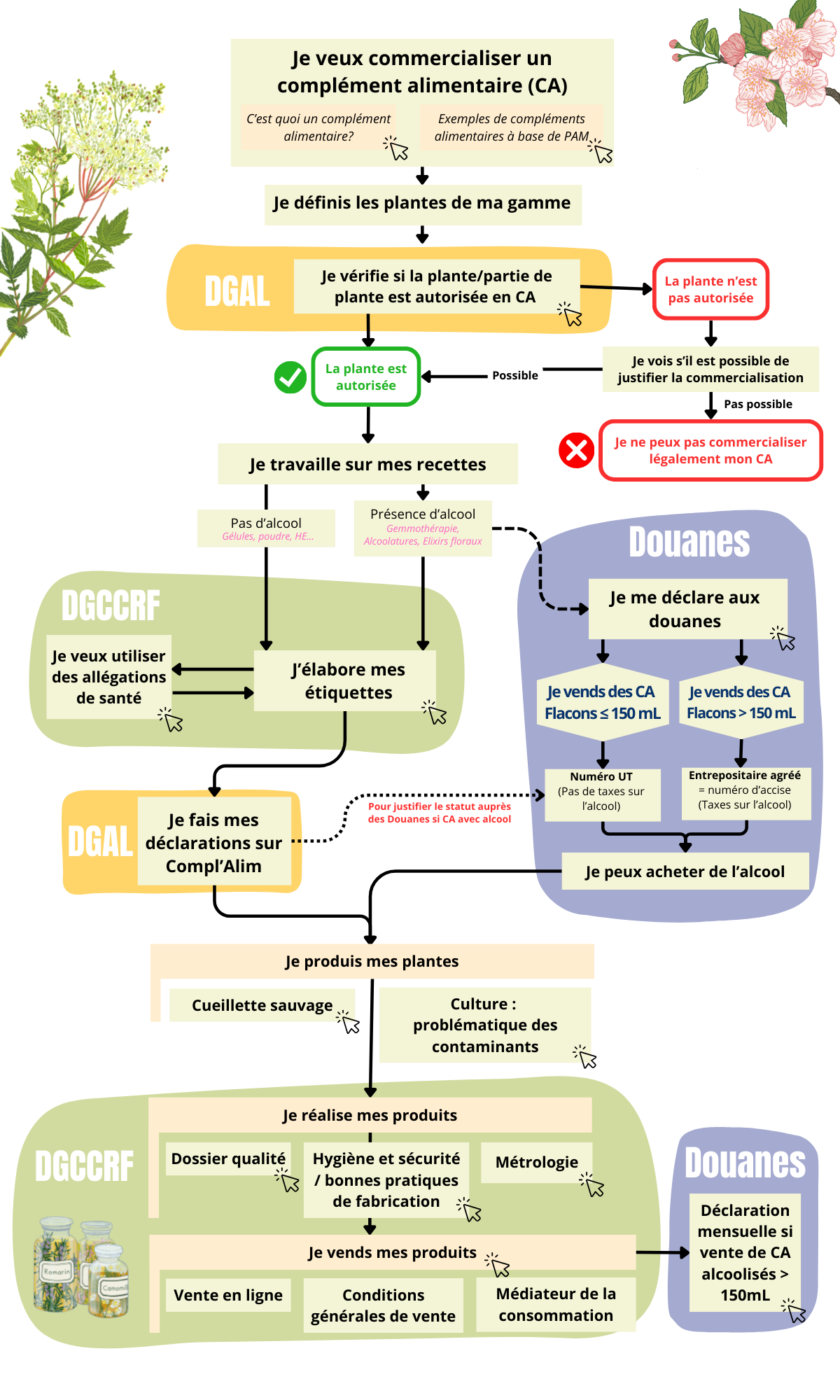
Pour les compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More, la réglementation sur les denrées alimentaires s’applique, avec en plus des spécificités qui leur sont propres.
Celles-ci sont réglementées par la Directive 2002/46/CE, transposée en droit français par le Décret n° 2006-352.
Définition
Décret n°2006-352 du 20 mars 2006
Art. 2
[Les compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More sont des] denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutrimentsVitamines et minéraux (Décret 2006-352 de l’art. 2). More ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les pastilles, les comprimés, les pilules et autres formes similaires, ainsi que les sachets de poudre, les ampoules de liquide, les flacons munis d’un compte-gouttes et les autres formes analogues de préparations liquides ou en poudre destinées à être prises en unités mesurées de faible quantité;
[…]
[Ils peuvent être constitués d’] ingrédients composés de végétaux ou isolés à partir de ceux-ci […] possédant des propriétés nutritionnelles ou physiologiques, à l’exclusion des plantes ou des préparations de plantes possédant des propriétés pharmacologiques et destinées à un usage exclusivement thérapeutique.
Les compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More présentent donc les caractéristiques essentielles suivantes :
- Ce sont des denrées alimentaires donc des produits qui s’ingèrent (voie orale). Un produit destiné à être appliqué sur la peau ou inhalé ne peut pas avoir le statut de complément alimentaire« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More.
- Objectifs : Complètent le régime alimentaire ≠ se substituer aux aliments courants
- Composition : Essentiellement des ingrédients ayant un effet nutritionnel ou physiologique
- Présentation : Sous forme de doses qui doivent être mesurable et de faible quantité (par rapport aux aliments consommés habituellement).
- Ne doivent pas pouvoir être considérés comme des médicaments :
- Par présentation : ils ne doivent pas être présentés comme possédant des propriétés curatives ou préventives à l’égard des maladies humaines ou animales
- Les allégations de santé sont autorisées
- ⚠ Les allégations thérapeutiques sont interdites
- Par fonction : ils ne doivent pas exercer d’action pharmacologique, immunologique ou métabolique.
- ne doivent pas avoir de caractéristiques communes avec des médicaments sur le marché (même type de produit, concentration, posologie)
- ne doivent pas avoir d’usage bien établi reconnu
- Par présentation : ils ne doivent pas être présentés comme possédant des propriétés curatives ou préventives à l’égard des maladies humaines ou animales
Exemples de compléments alimentaires à base de plantes médicinales
Ci-après une liste non exhaustive de compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More proposées par les producteur.rice.s PPAM :
- Alcoolatures
- Gemmothérapie
- Elixirs floraux
Plantes dans les compléments alimentaires
L’arrêté du 24 juin 2014 établit une liste des plantes, autres que les champignons, autorisées dans les compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More (Annexe 1) et les conditions de leur emploi.
Cette liste publiée au Journal Officiel contenait au départ 540 plantes mais en prévoyant un mécanisme d’élargissement de ce nombre par un mécanisme de reconnaissance mutuelle entre les états membres de l’Union Européenne (article 16).
La liste des ingrédients pouvant entrer dans la fabrication des compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More et leur statut (déclarable, non autorisé, …) peuvent être consultés sur le site Compl’Alim de la DGALDirection Générale de l'Alimentation, un service du Ministère de l'Agriculture More. Cette fonctionnalité est publique et ne nécessite pas d’avoir de compte sur le site.
Acheter de l’alcool
Etiquetage
Voir Exemple d’étiquettes de gemmothérapie
Précautions d’emploi et contre-indications
Les précautions d’emploi et contre-indications, si elles sont applicables, doivent figurer sur l’étiquetage des compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More.
Certaines d’entre elles sont imposées pour pouvoir déclarer un complément alimentaire« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More. Il est possible de les retrouver :
- Dans la colonne « Restrictions » du tableau de l’annexe I de l’arrêté du 24 juin 2014.
- En consultant la base de données des ingrédients autorisés dans les compléments alimentaires de Compl’Alim. La consultation de cette base de données ne nécessite pas forcément la création d’un compte utilisateur.
Dans ces 2 casChemical Abstracts Service (CAS) est une division de l'American Chemical Society (ACS) More, les informations concernant les précautions d’emploi et contre-indications à déclaration obligatoire ne sont pas nécessairement exhaustives et d’autres mentions pourront être exigées par la DGALDirection Générale de l'Alimentation, un service du Ministère de l'Agriculture More lors de l’enregistrement du complément alimentaire« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More : pensez à garder un peu de place sur votre étiquette !
En 2023, l’ANSESAgence Nationale de Sécurité Sanitaire de l’alimentation, de l’environnement et du travail.
Établissement public à caractère administratif, elle est sous la tutelle des ministères de la santé, de l’environnement, de l’agriculture, et du travail. More a émis un avis concernant les avertissements et recommandations applicables à 118 plantes médicinales utilisées dans les compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More. Cette position étant reprise par la DGALDirection Générale de l'Alimentation, un service du Ministère de l'Agriculture More, les précautions et restrictions d’usage figurant dans ce document sont nécessaires pour pouvoir déclarer un complément alimentaire« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More.
Pour comprendre les exigences, la consultation de cet avis peut être utile : Avis relatif à l’évaluation de la pertinence de l’applications des avertissements et recommandations exprimés dans les monographies de plantes médicinales de l’EMA aux compléments alimentaires contenant ces mêmes plantes.
En raison de la lourdeur de cet avis (de 542 pages !) l’ANSESAgence Nationale de Sécurité Sanitaire de l’alimentation, de l’environnement et du travail.
Établissement public à caractère administratif, elle est sous la tutelle des ministères de la santé, de l’environnement, de l’agriculture, et du travail. More propose également un tableau permettant de faire la synthèse des informations par plante de manière plus pratique d’utilisation : Tableau d’information sur les plantes médicinales utilisées dans des compléments alimentaires nécessitant des précautions d’emploi
Dans certains casChemical Abstracts Service (CAS) est une division de l'American Chemical Society (ACS) More, il est possible d’échanger avec la DGALDirection Générale de l'Alimentation, un service du Ministère de l'Agriculture More pour essayer de justifier de l’absence de pertinence pour certaines mentions qui sont exigées.
En effet, ces phrases ne tiennent compte ni de la partie de la plante, ni de la forme galénique (HE, alcoolature, poudre de plante, …), ni de la posologie proposée.
Gardez cependant à l’esprit que vous n’avez pas à faire en face à des experts de la phytochimie et qu’il ne sera pas toujours facile de faire entendre vos arguments. N’hésitez pas à faire remonter vos problématiques au Syndicat SIMPLES qui essayera de dialoguer avec la DGALDirection Générale de l'Alimentation, un service du Ministère de l'Agriculture More à un autre niveau.
Allégations nutritionnelles et de santé
Il est possible de mettre en avant certaines propriétés nutritionnelles et/ou de santé sur des denrées alimentaires.
Ces allégations sont encadrées par le réglement européen n°1924/2006.
Voir Les allégations nutritionnelles et de santé
Déclaration des compléments alimentaires
La mise sur le marché des compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More est contrôlée par la DGALDirection Générale de l'Alimentation, un service du Ministère de l'Agriculture More. Il s’agit d’une procédure déclarative obligatoire, pas d’une autorisation de mise sur le marchéAutorisation délivrée par l’ANSM, indispensable à la commercialisation et à la distribution de toute spécialité pharmaceutique en France (CSP, art. L5121-8). More. Chaque producteur.ice est et reste donc responsable des produits qu’il déclare et de leur conformité à la réglementation.
La déclaration se fait sur le portail Compl’Alim de la DGALDirection Générale de l'Alimentation, un service du Ministère de l'Agriculture More. Voir le tutoriel ici.
Jusqu’en septembre 2024, le portail se dénommait Téléicare et était géré par la DGCCRFDirection générale de la concurrence, de la consommation et de la répression des fraudes More.
Des retours de déclaration parfois source de confusion
Lors de la déclaration sur Compl’Alim, chaque dossier peut faire l’objet d’une vérification de certains paramètres par les agents de la DGALDirection Générale de l'Alimentation, un service du Ministère de l'Agriculture More. Ces contrôles ne sont pas systématiques et ne portent pas sur l’ensemble des critères imposés par la réglementation : des modifications portant pourtant sur les mêmes points peuvent être exigées sur certains dossiers et pas sur d’autres.
Le facteur humain existe aussi, les exigences et interprétations pouvant différer légèrement suivant l’agent en charge de contrôler le dossier.
Cueillette de plantes sauvages
La cueillette des plantes sauvages doit respecter les règlementations liées au espèces et aux espaces naturels protégés.
Voir Cueillette de plantes sauvages
Cultiver les PPAM : la question des contaminants
Au niveau de la règlementation, il existe des seuils concernant différents contaminants pouvant se retrouver dans les cultures. Des contrôles peuvent être effectués par les services de l’Etat pour mesurer le taux de ces contaminants dans les produits à base de PPAM.
Voir Les contaminants
Dossier qualité
L’article 7 de l’arrêté du 24 juin 2014 précise que les fabricants de compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More doivent tenir à disposition, en casChemical Abstracts Service (CAS) est une division de l'American Chemical Society (ACS) More de contrôle, un document permettant de garantir la qualité des matières premières et impose d’y faire figurer un certain nombre d’informations listées à l’annexe II.
Les principaux objectifs sont :
- Apporter la preuve qu’on maîtrise les dangers connus.
- Définir avec rigueur l’identification de la matière première végétale, le procédé de transformation, la caractérisation de la préparation et, de manière générale, les conditions de production jusqu’au produit fini.
Le dossier qualité n’est pas une obligation nouvelle : la sécurité d’emploi des préparations de plantes peut être garantie par le recours aux principes du système HACCP. A ce titre, il vient compléter le plan de maîtrise sanitaire.
Il doit notamment contenir, si elles s’avèrent pertinentes, les informations concernant :
- Matière première
- Source botanique : identité, partie utilisée, origine géographique
- Pratiques culturales : sauvage/cultivé, récolte, séchage, stockage, traitement
- Matières premières : référentiel utilisé et tests effectués, dosage des substances d’intérêt et des constituants toxiques à limiter, pureté
- Process
- Étapes de fabrication
- Informations sur méthodes, appareils, ratio plante/extrait (qté plante sèche/qté extrait final)
- Caractériser les métabolites d’intérêt, marqueurs, métabolites à risque
- Pureté : pesticides, mycotoxines, résidus de solvants, métaux lourds, microbiologie, HAP, contaminants…
- Produit fini
- Conditions de stockage
- Stabilité : propriétés organoleptiques, microbiennes, physico-chimiques
- Conditionnement : type, matériaux de contact
- Conditions de transport et de stockage
- Surveillance post commercialisation : numéro conso, étude des casChemical Abstracts Service (CAS) est une division de l'American Chemical Society (ACS) More, gestion des signalements
L’arrêté ne propose pas de formalisme particulier, c’est à chacun.e de définir le niveau d’exigence adapté pour assurer la qualité de sa préparation. En tant que producteur/trice en circuits courts et vente directe, vous maîtrisez la traçabilité de vos matières premières, vos procédés de fabrication et modes de commercialisation. Le contenu de ce document peut donc être relativement succinct.
Il peut renvoyer vers des éléments de votre plan de maîtrise sanitaire.
Arrêté du 24 juin 2024 6 Annexe II
« La nature des informations à communiquer dépend du casChemical Abstracts Service (CAS) est une division de l'American Chemical Society (ACS) More d’espèce et de l’analyse des risques réalisée par l’exploitant du secteur alimentaire concerné.«
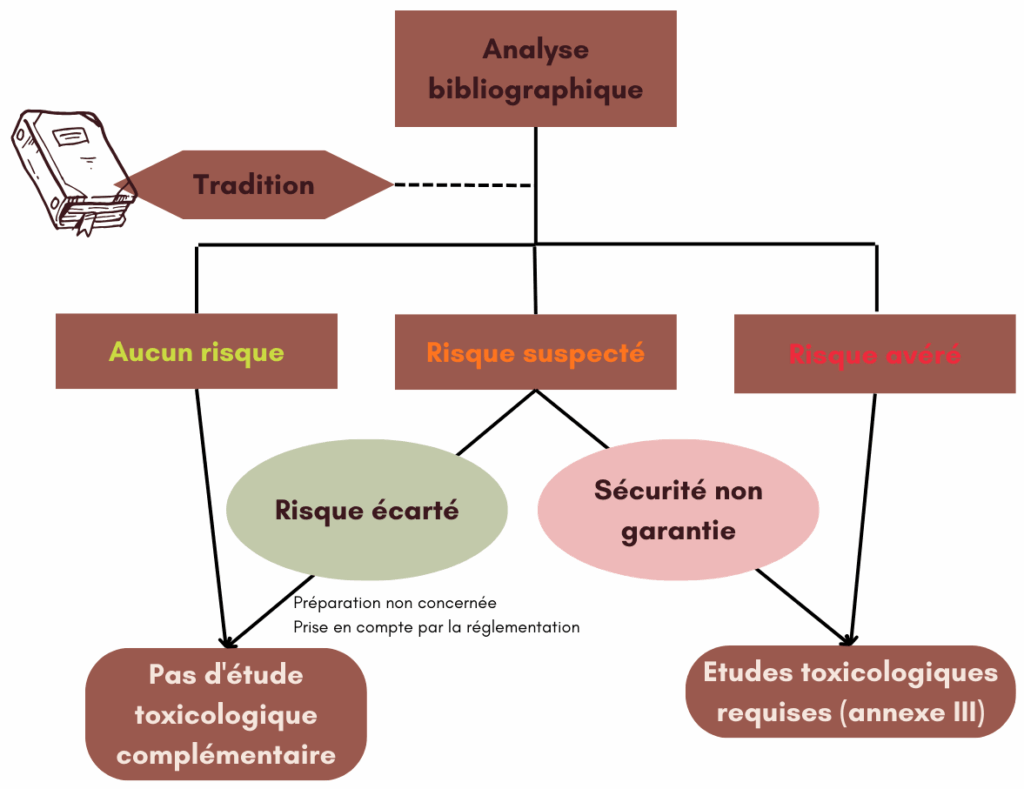
Dossier toxicologique
L’article 9 de l’arrêté du 24 juin 2014 précise que lorsque la nature ou les conditions d’emploi diffèrent significativement de l’usage traditionnel, les fabricants doivent tenir à disposition, en casChemical Abstracts Service (CAS) est une division de l'American Chemical Society (ACS) More de contrôle, un document permettant de garantir la sécurité des préparations innovantes à base de plantes et impose d’y faire figurer un certain nombre d’informations listées à l’annexe III.
Sauf exception, la plupart des produits avec le statut de complément alimentaire« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More réalisé par les petit.e.s producteur.ice.s (alcoolatures, macérats de gemmothérapie, HE) sont des préparations bénéficiant de recul d’usage traditionnel, un dossier toxicologique complémentaire n’est donc pas exigé.
D’autant que les précautions d’emploi et substances à surveiller critiques correspondant aux plantes utilisées sont à préciser lors de l’enregistrement du complément alimentaire« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More sur Compl’Alim.
Le schéma ci-dessous permet de comprendre si des analyses toxicologiques supplémentaires sont nécessaires :
Bonnes pratiques d’hygiène
Des bonnes pratiques d’hygiène spécifiques aux compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More ont été rédigées et sont publiées sur le site du SYNADIET : Charte qualité annexes 5-a et 5-b.
Ces bonnes pratiques ne sont pas forcément applicables en l’état dans leur totalité à échelle artisanale mais en attente d’un document élaboré par une commission de travail du Syndicat SIMPLES sur le sujet, ces documents peuvent donner des idées à adapter.
Voir aussi Plan de maitrise sanitaire et HACCP
Métrologie
La métrologieScience des mesures. More est la science des mesures.
Les compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More étant des produits préemballés a fortiori présentés sous forme d’unités.
Voir page Métrologie
Vente
La vente des compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More est libre.
Si un complément alimentaire« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More contient des plantes du monopole pharmaceutiqueContrat entre l’État et l’Ordre des Pharmaciens qui réserve aux seul·es pharmacien·nes le droit de dispenser des produits de santé. En retour, les pharmacien·nes s’engagent à respecter le code de la santé publique et le code de déontologie. Lors de leur exercice, ils et elles mettent en jeu leur responsabilité... More qui ont été autorisées dans les compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More (arrêté du 24 juin 2014) alors ces derniers peuvent être vendus par des personnes autres que des pharmacien⋅nes (CSP, art. D4211-12).
Il existe une exception :
Si une plante est autorisée dans les compléments alimentaires« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More mais est aussi inscrite à la liste B de la pharmacopée, alors la vente du complément alimentaire« Les denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d’autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses, à savoir les formes de présentation telles que les gélules, les... More est réservée aux pharmacien⋅nes.
Voir la page Vente des produits à base de plantes
Ressources utiles
- Guide de lecture de l’arrêté Plantes de la DGCCRF
Ce document administratif (droit mou) propose une interprétation par l’administration de l’application de l’arrêté plante. - Page de la Direction Générale de l’Alimentation (DGAL) sur la réglementation des compléments alimentaires

